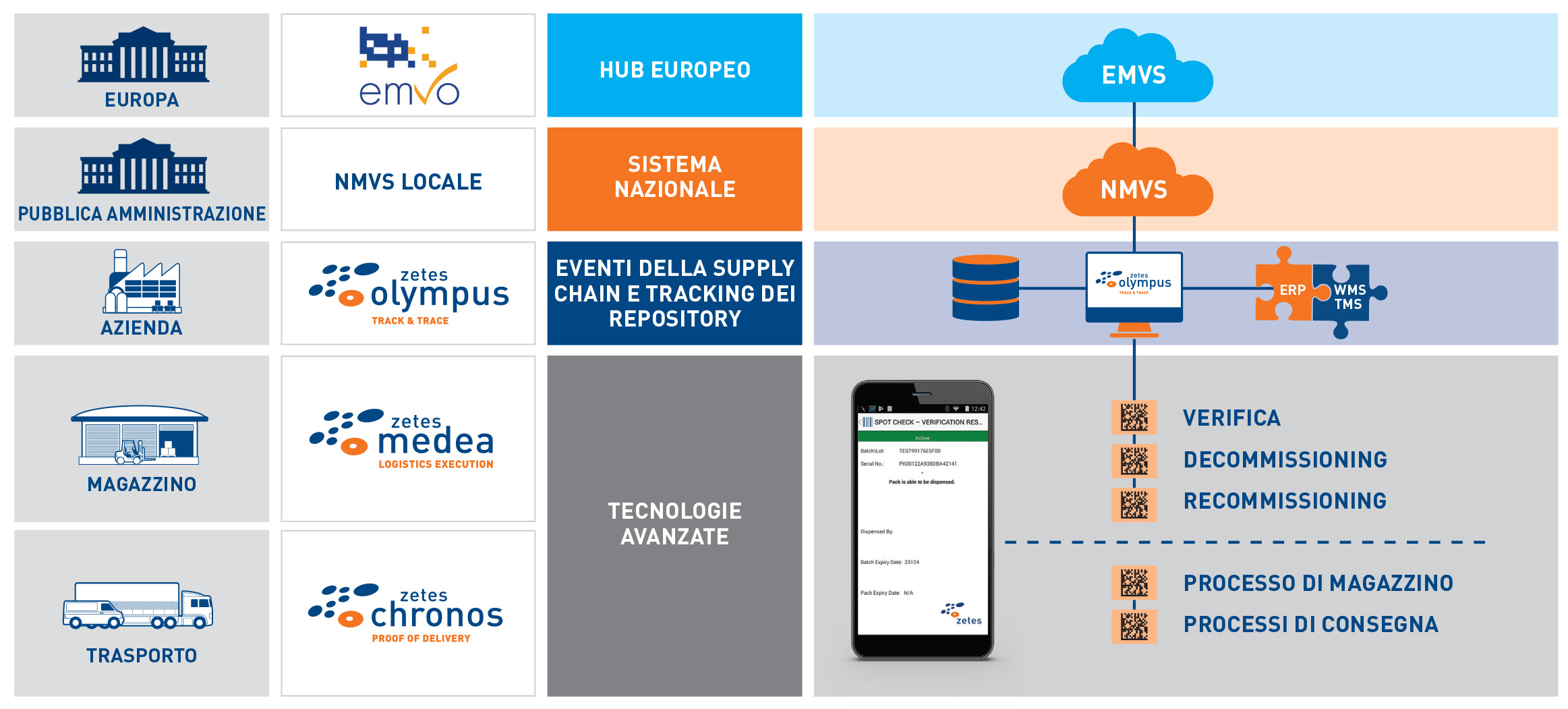
Potente piattaforma mobile per la gestione delle applicazioni e degli eventi
Il nostro esclusivo approccio, completamente integrato, offre ai clienti la massima tranquillità. L'approccio è basato su tre pilastri:
Applicazione mobile FMD
Consente la scansione rapida e facile dei codici Datamatrix utilizzando dispositivi portatili per acquisire dati e verificare o eseguire il decommissioning dei farmaci.
1
Potente piattaforma per la tracciabilità e la visibilità degli eventi
Comunicazione diretta con l'hub nazionale (NMVS). Registrazione di tutti gli eventi collegati alla verifica e al decommissioning per un arco di tempo fino a 10 anni.
2
Robusta integrazione di sistemi
Con oltre 40 anni di esperienza nell'integrazione dei sistemi per la supply chain, assicuriamo una perfetta integrazione con sistemi legacy (obsoleti). Il nostro approccio collaudato e privo di rischi consente ai clienti di rispettare di ottemperare agli obblighi di conformità nei tempi previsti.
3
Sfrutta il tuo investimento
La modularità del nostro approccio offre innegabili vantaggi economici, oltre a soddisfare i requisiti richiesti dall'imminente entrata in vigore della Direttiva FMD; permette infatti di utilizzare l'investimento in conformità per cogliere i frutti di una maggiore efficienza e tracciabilità, dal magazzino al punto di erogazione. La soluzione FMD si integra perfettamente con la soluzione di esecuzione logistica ZetesMedea, aggiungendo ulteriore flessibilità ed efficienza ai processi di magazzino. Oltre a ciò, con la nostra soluzione mobile proof of delivery ZetesChronos, è possibile garantire consegne puntuali e accurate, per conseguire visibilità e tracciabilità in tempo reale anche in questo ambito.