Solución integrada para garantizar la conformidad
La Directiva sobre medicamentos falsificados (FMD) 2011/62/UE entró en vigor el 9 de febrero de 2019.
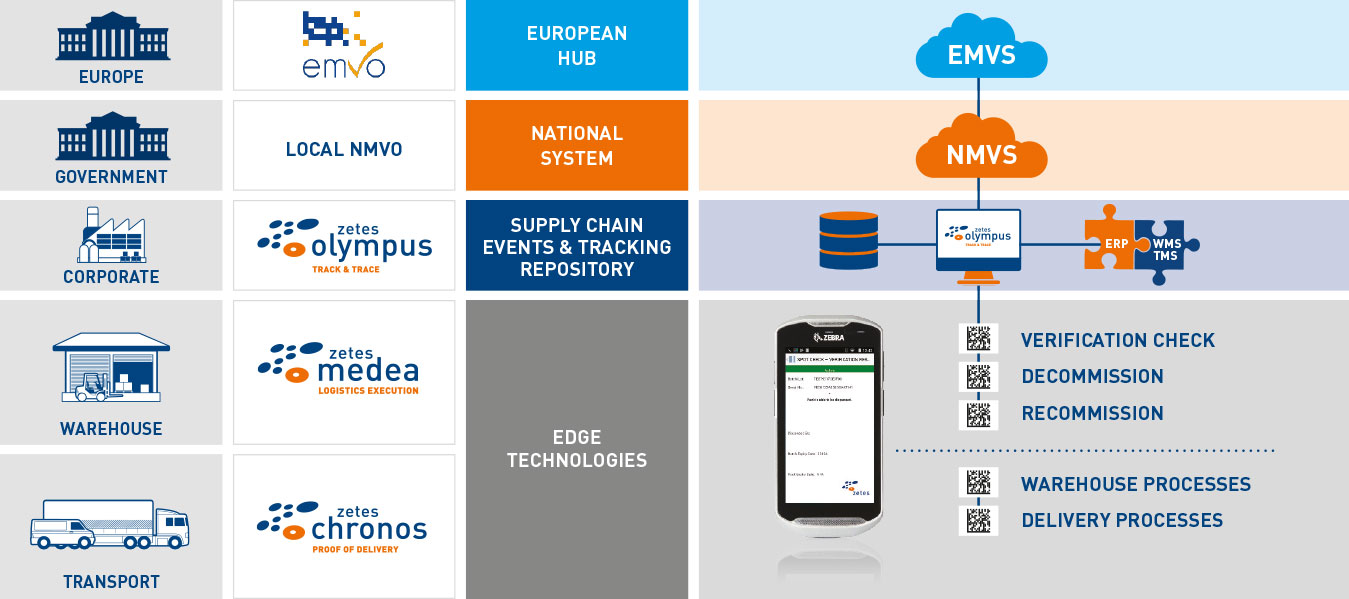
Como mayorista, para garantizar la conformidad con esta directiva debe poder realizar una verificación, retirada o reintroducción de los estuches serializados a partir de una evaluación de los riesgos. En Zetes le podemos ayudar integrando una solución de lectura y descodificación de códigos de barras Datamatrix 2D en sus operaciones de almacén con una conexión directa al sistema nacional de verificación (NMVO) de su país. Descubra nuestra solución, que se integra con sus sistemas y procesos de forma económica.