Direttiva sui medicinali falsificati: come Grossisti e Operatori Logistici possono assicurare la conformità
Scopri di più Contatti
Quali sono i requisiti richiesti dalla Direttiva sui medicinali contraffatti?
In generale, i requisiti di questa direttiva (FMD 2011/62/EU) rientrano in cinque categorie:
- Indicazione obbligatoria sull'involucro esterno del medicinale per l'identificazione e la verifica del prodotto
- Marcatura obbligatoria sull'imballaggio esterno dei medicinali per dimostrare l'assenza di manomissioni
- Obblighi di legge correlati alle possibilità di ispezione, sempre più rigidi per i produttori di ingredienti farmaceutici attivi
- Obbligo per produttori e distributori di segnalare qualsiasi sospetto di falsificazione dei medicinali
- Necessità di apporre un logo sui siti Web delle farmacie che operano legalmente online, con un collegamento ai registri ufficiali nazionali.
Una soluzione end-to-end per la conformità alla Direttiva sui medicinali falsificati
Quali esperti di integrazione dei processi e delle tecnologie per il magazzino, aiutiamo le case farmaceutiche e i grossisti in tutta Europa a garantire la conformità alla Direttiva sui medicinali falsificati, in modo economico ed efficiente. La nostra soluzione rivolta ai grossisti, integrata e completa, comprende:
- Verifica del numero di serie "risk-based"
- Decommissioning e recommissioning del numero di serie
- Decommissioning conforme all'Articolo 23
- Pubblicazione sul sistema NMVS (National Medicines Verification Systems) locale
- Funzionalità di reporting e cronologia degli eventi
- Se richiesto, ulteriore ottimizzazione dei processi di magazzino e implementazione di funzionalità Track & Trace
Una soluzione integrata per garantire la conformità
La Direttiva sui medicinali falsificati (FMD) 2011/62/UE entrerà in vigore il 9 febbraio 2027 in Italia. Anche l’Italia, dopo una serie di proroghe, dovrà adempiere alla direttiva come già avvenuto nel resto d’Europa. Quindi anche in Italia ai fini di rispettare gli obblighi di conformità per il mercato internazionale, i grossisti dovranno a breve essere in grado di condurre verifiche "risk-based", decommissioning o recommissionig di confezioni serializzate. Aiutiamo i clienti a garantire la conformità ottimizzando i processi di magazzino con funzionalità di scansione e decodifica di codici a barre 2D data matrix e connessione diretta al sistema di verifica NMVO nazionale. Scopri la nostra soluzione integrata ed economica interamente adeguabile ai sistemi e processi esistenti.
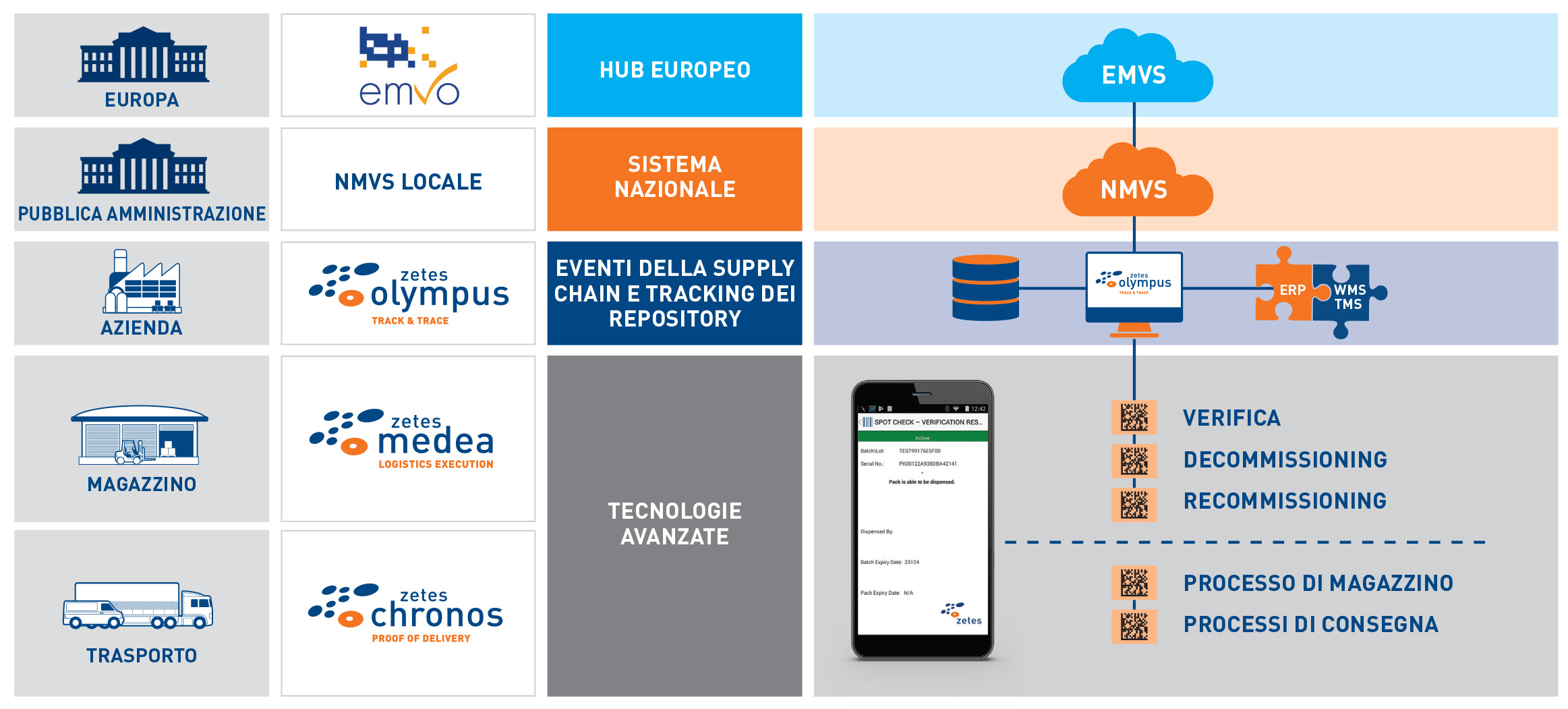
Potente piattaforma mobile per la gestione delle applicazioni e degli eventi
Il nostro esclusivo approccio, completamente integrato, offre ai clienti la massima tranquillità. L'approccio è basato su tre pilastri:
Applicazione mobile FMD
Consente la scansione rapida e facile dei codici Datamatrix utilizzando dispositivi portatili per acquisire dati e verificare o eseguire il decommissioning dei farmaci.
Potente piattaforma per la tracciabilità e la visibilità degli eventi
Comunicazione diretta con l'hub nazionale (NMVS). Registrazione di tutti gli eventi collegati alla verifica e al decommissioning per un arco di tempo fino a 10 anni.
Robusta integrazione di sistemi
Con oltre 40 anni di esperienza nell'integrazione dei sistemi per la supply chain, assicuriamo una perfetta integrazione con sistemi legacy (obsoleti). Il nostro approccio collaudato e privo di rischi consente ai clienti di rispettare di ottemperare agli obblighi di conformità nei tempi previsti.
Sfrutta il tuo investimento
La modularità del nostro approccio offre innegabili vantaggi economici, oltre a soddisfare i requisiti richiesti dall'imminente entrata in vigore della Direttiva FMD; permette infatti di utilizzare l'investimento in conformità per cogliere i frutti di una maggiore efficienza e tracciabilità, dal magazzino al punto di erogazione. La soluzione FMD si integra perfettamente con la soluzione di esecuzione logistica ZetesMedea, aggiungendo ulteriore flessibilità ed efficienza ai processi di magazzino. Oltre a ciò, con la nostra soluzione mobile proof of delivery ZetesChronos, è possibile garantire consegne puntuali e accurate, per conseguire visibilità e tracciabilità in tempo reale anche in questo ambito.
Chi aiutiamo?
“È diffusa la preoccupazione che per ottenere la conformità alla Direttiva sui medicinali falsificati sia necessario ricorrere a cambiamenti drastici nel magazzino. Non deve necessariamente essere così”
Christian Taylor - Esperto di serializzazione presso Zetes
Leggi l'articoloMaggiori informazioni?
ContattiCome possiamo aiutarti?
- Produttori del farmaceuti e CMO: La nostra soluzione di serializzazione farmaceutica ZetesAtlas ti aiuta a garantire la conformità con la direttiva. Vi offriamo un approccio collaudato e un unico punto di contatto per mitigare i rischi e assicurare un'implementazione rapida del progetto in modo da essere pronti nei tempi e nei limiti del budget
- Grossisti e fornitori di servizi logistici: La nostra soluzione di conformità FMD * consente al vostro magazzino di eseguire verifiche basate sul rischio, decomissioning e recomissioning dei pacchetti serializzati
