Dal 9 febbraio 2019, tutti gli stakeholder della supply chain farmaceutica, ovvero case farmaceutiche, distributori, grossisti, farmacie e cliniche, devono conformarsi alla direttiva sui medicinali falsificati (FMD). L'obiettivo principale della direttiva è garantire una maggiore la sicurezza nelle fasi di produzione e consegna dei farmaci in tutta Europa, per proteggere i pazienti e impedire a medicinali falsificati di penetrare nella supply chain.
Per molte di queste aziende, la conformità alla direttiva FMD ha comportato significativi interventi di riprogettazione dei processi per potere ricevere, controllare ed effettuare il decommissioning di medicinali serializzati. In particolare per le farmacie di strutture cliniche, la mancanza di un flusso di lavoro altamente efficiente può potenzialmente presentare considerevoli ripercussioni su un sistema sempre più sotto pressione.

Affidarsi a processi manuali per la gestione di farmaci serializzati a livello di singola confezione è un processo che richiede molto tempo e manodopera e può interferire con le normali procedure. Anziché considerare la direttiva FMD dal punto di vista della sola conformità, si dovrebbe valutarla in un contesto più ampio, vedendo così chiaramente che le aziende dovrebbero implementare tale normativa principalmente per promuovere un cambio di mentalità lungo la supply chain del settore farmaceutico.
Sébastien Sliski, General Manager Supply Chain Solutions, per Zetes, sottolinea come processi di gestione dell'inventario che sfruttano funzionalità digitali quali l'aggregazione e il consolidamento possono aiutare le farmacie delle strutture cliniche e i grossisti che le riforniscono non solo a soddisfare i requisiti di conformità alla direttiva FMD in modo più efficiente, ma anche a ottenere livelli di efficienza elevati.
Nel mondo della FMD
La direttiva sui medicinali falsificati (FMD) si applica a tutte le farmacie delle strutture cliniche in Europa. Tuttavia, molte strutture cliniche, farmacie e grossisti in tutta Europa restano ancora non conformi [in English]. Sebbene molti Paesi abbiano introdotto periodi di stabilizzazione post-entrata in vigore per facilitare la transizione e prevenire carenze di medicinali, questi stanno ormai volgendo al termine.
Il requisito principale richiesto dalla direttiva FMD è l'autenticazione e il decommissioning dei farmaci prima di distribuirli ai pazienti. Ciò è richiesto anche in tutte le cliniche, insieme alla verifica basata sul rischio e alla tracciabilità dei farmaci a livello di grande distribuzione.
Le farmacie delle strutture cliniche sono tenute a controllare il sistema antimanomissione (ATD) per assicurarsi che sia integro prima di distribuire il farmaco e a modificare lo stato della confezione nel sistema nazionale di verifica dei medicinali (NMVS) da "attivo” a "inattivo fornito“. Ciò richiede la scansione del codice a barre 2D di ogni confezione per verificare l'identificatore univoco (UI) di un prodotto, applicato dal produttore all'etichetta sulla confezione, oltre alla comunicazione al NMVS. Una volta effettuata la verifica, è possibile eseguire il decommissioning del farmaco. Diversamente da una farmacia pubblica, in cui è possibile effettuare il decommissioning dei farmaci solo al momento della consegna al paziente, le farmacie di strutture cliniche possono effettuare questa operazione in qualsiasi momento dopo la verifica.
Data l'importanza del processo di distribuzione del farmaco da parte della farmacia ai fini dell'efficienza complessiva di una struttura clinica e per via del numero crescente di prodotti di nicchia altamente complessi che richiedono il rispetto di modelli di distribuzione ed erogazione specializzati, è fondamentale che questo processo sia corretto. È essenziale che le farmacie di strutture cliniche possano gestire il processo di verifica e di decommissioning nel modo più agevole possibile, dato il potenziale effetto a cascata della scansione delle singole confezioni sul processo di distribuzione e scarico.
Aggregazione e consolidamento
La buona notizia è che è possibile eliminare i processi manuali. È ora disponibile una tecnologia in grado di consolidare le informazioni digitali delle interfacce utente dei singoli prodotti nelle etichette dei codici a barre, permettendo alle farmacie delle strutture cliniche di effettuare il decommissioning di un'intera spedizione con una singola scansione.
Ciò offre notevoli risparmi di tempo ed efficienza; vantaggi che possono propagarsi a cascata lungo la supply chain fino ai grossisti, ai fornitori di servizi logistici esterni e alla casa farmaceutica, attraverso quattro semplici passi:
Passo 1: Aggregazione
Presso il magazzino del produttore o del grossista, viene eseguita la scansione dei singoli prodotti, che successivamente vengono aggregati in scatole e/o pallet. Per il grossista, questo approccio consente di preparare le spedizioni in anticipo e di ridurre i tempi di consegna necessari a completare una spedizione, mentre la farmacia della struttura clinica può scegliere a che livello desidera effettuare il decommissioning dei prodotti.
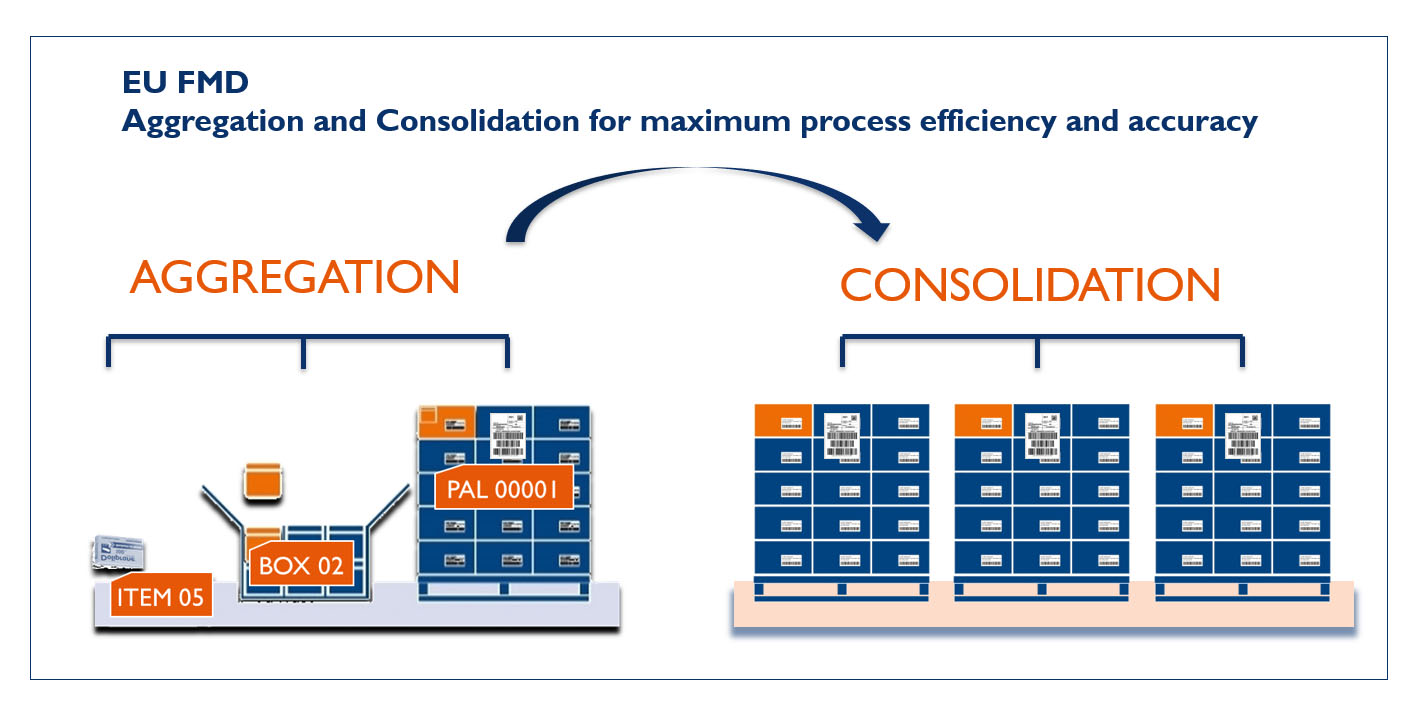
Passo 2: Consolidamento
Le unità aggregate vengono consolidate in un numero di ordine univoco. Questo può avvenire in qualsiasi punto del processo di magazzinaggio.
Passo 3: Comunicazione
Alle unità aggregate viene applicata un'etichetta con codice a barre riportante il numero di ordine univoco. Il processo di spedizione è inoltre identificato da un numero univoco, che può essere fisicamente inserito nella documentazione relativa al trasporto. Parallelamente, un file digitale con questi identificatori univoci viene condiviso con la clinica al momento della spedizione.
Passo 4: Controllo casuale e decommissioning
Al ricevimento della spedizione, i numeri dei codici a barre e il file digitale sono disponibili per la clinica, che può eseguire controlli casuali ed effettuare automaticamente il decommissioning dei prodotti al livello specificato.
L'adozione dei processi di aggregazione e consolidamento non solo consente di affrontare i requisiti della conformità alla direttiva FMD nel modo più efficiente possibile, ma offre anche la possibilità di identificare ulteriori miglioramenti nel flusso di lavoro della farmacia, ottimizzando ulteriormente il processo di scarico dei farmaci. Inoltre, il settore nel suo complesso ha la possibilità di ripensare la propria attività travalicando i confini istituzionali e aziendali e di iniziare a valutare l'implementazione di trasparenza lungo una supply chain farmaceutica più ampia.
Conclusione
Con le giuste soluzioni digitali è possibile assicurare visibilità lungo la supply chain, garantendo che i pazienti di tutto il mondo abbiano accesso a farmaci di alta qualità, senza il rischio di assumere un prodotto contaminato o contraffatto.
Supportare i processi legati ai pazienti, assicurandosi che a coloro che si trovano in attesa di dimissioni vengano tempestivamente prescritti i farmaci necessari è essenziale per la farmacia di una struttura clinica. Tuttavia, la direttiva FMD va oltre. Con le giuste soluzioni digitali è possibile assicurare visibilità lungo la supply chain, garantendo che i pazienti di tutto il mondo abbiano accesso a farmaci di alta qualità, senza il rischio di assumere un prodotto contaminato o contraffatto.